バッチ生産から連続生産へ
製薬業界において、医薬品製造コスト削減のため製造方法を見直す研究が進められてきた。近年は環境変化と技術革新に伴い、50年以上にもわたり中心であったバッチ生産から連続生産への製造革新が進行している。バッチ生産は一つの工程ごとに原材料・生成物を装置に投入し、反応・精製等の処理により生成物を作り、それを取り出し次の工程に投入していく方式である。これに対し、連続生産は各工程の装置を接続し、自動制御により原材料が装置に投入されると生成物が自動的に次工程に投入されていく方式である(図1参照)。
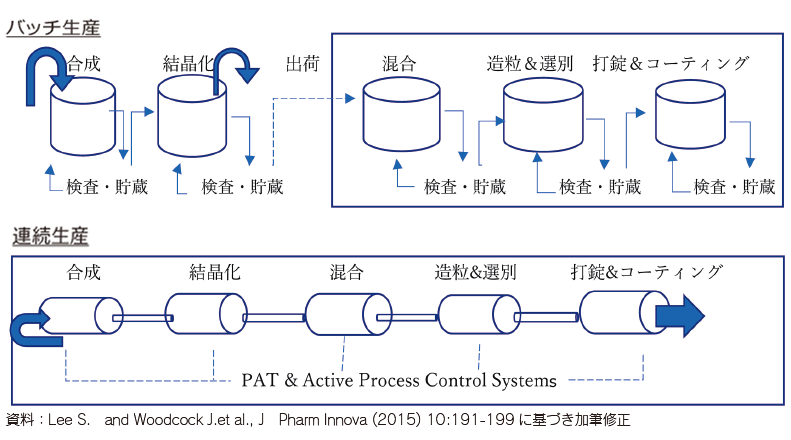
図1:連続生産に対するFDAの考え方
バッチ生産は個々の工程ごとに試験ができ、品質管理がしやすいメリットがある。しかし、スケールアップ(生産規模の拡大)対応には新規設備投資が必要となり、また生産効率を高めるうえでロット数量(工程1バッチあたりの生産数量)を大きくする必要があるため、需要変動に対応した少量生産が難しかった。一方、連続生産はバッチ生産のこれらの弱点を克服する生産方式であり、化学や食品産業では、連続生産の導入により、バッチごとの原材料の入れ替えの省力化、オートメーション化が図られてきた。
米国におけるFDAと企業の連続生産への取り組み
医薬品製造では安全のために厳しい品質管理基準が求められ、アメリカ食品医薬品局(FDA)は伝統的なバッチ生産を前提に適性製造基準(GMP)等を提示してきた。しかし、環境変化と技術革新の中で、2000年以降連続生産導入の気運が高まった。その契機となったのは、2002年FDAが「cGMPs for the 21st Century Initiative」で示したリスクベースアプローチであった。当時のファイザーの資料の中でも、販売後の競合台頭による需要変化、後発医薬品の普及や医薬品価格への社会的圧力から新たなコスト削減方策と少量生産の仕組みが求められることから、連続生産がそのための手段として有力であることを指摘していた。特に、技術革新により生成物が流路を通過する中でリアルタイムモニタリングを行うことにより、品質管理が可能となってきたため連続生産の適用可能性が高まったのである。このような流れから、2011年FDAは医薬品製造に関してバッチ生産から連続生産に着実に転換していくべきとの指針を示した。2015年にFDAはエマージング・テクノロジーの認定制度を始めたが、その中でも連続生産に関わる技術が多くを占めていた。
このようなFDAの方針を受け、製薬企業は連続生産の導入に着手し始めた。ヤンセンファーマは抗HIV薬に連続生産を適用した。ファイザー、グラクソスミスクライン等は連続生産に関する共同研究開発を開始した。ノバルティスはマサチューセッツ工科大学と連続生産の研究センターを設立し、戦略パートナーのライセンス生産を目指している。現時点では、バーテックスファーマ、ヤンセンファーマ、イーライリリー、ファイザーの4社が連続製造による承認申請を行っている。
日本における連続生産への対応
日本においても、災害危機や少子高齢化による医薬品需要の変化が想定され、連続生産を活用する気運が高まる。シオノギファーマやエーザイが連続生産による新薬製造を申請し、革新技術を使い商用化が始まっている。2015年に産官学連携による触媒技術を活用するフロー精密合成コンソーシアムが発足された。2018年度からNEDO (国立研究開発法人新エネルギー・産業技術総合開発機構)の戦略的省エネルギー技術革新プログラムとして、産業技術総合研究所と民間企業8社が連続生産とバッチ方式の利点を組み合わせた、再編可能なモジュール型工場iFactory®の開発に取り組んでいる(図2参照)。実証実験で8割のエネルギー節約と3~4割の廃棄物削減を確認、実用化に進むことを今年6月公表した。iFactory®が目標にしているのは、「必要なモノを必要な時に必要な量作る」オンデマンド生産である。
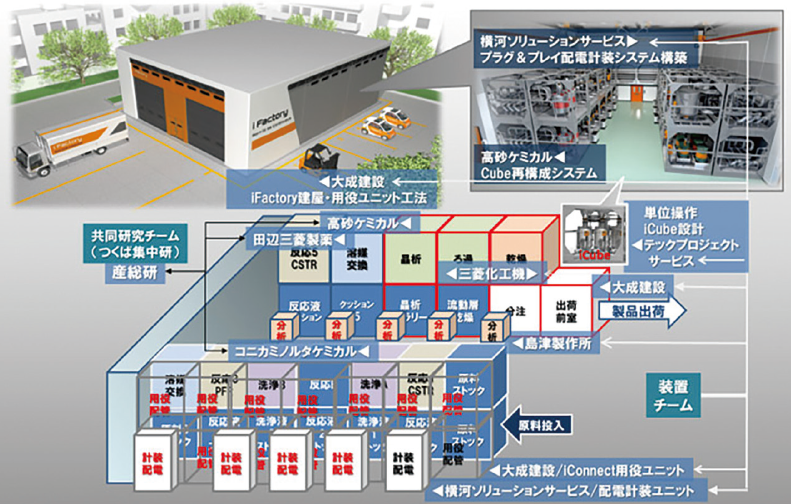
図2:iFactoryの工場設計図(NEDOホームページより)
日本の医薬品企業は研究開発からマーケティングまでの垂直統合モデルが高コストを招いてきた。連続生産方式の導入はこの問題を解決することが期待される。エコシステムの発想で研究開発、臨床試験、生産、販売の分業を行い、単独企業のコストを産業全体で最適に配分することで医療経済性を向上できるだろう。そして、人口減少社会でも少数の患者が必要とする多品種の医薬品供給システムのコストパフォーマンスを改善することができる。
日本が世界に誇る精密加工機器、計測制御機器とプロセスエンジニアリングを統合した「スマート・ファクトリー」を世界に発信するとともに、産業間の戦略連携による新たなエコシステム創造が期待される。
【シニアアナリスト 歌代 洋子】










